|
2 アルカリ土類金属(2族元素)h
【単体】
|
 |
|
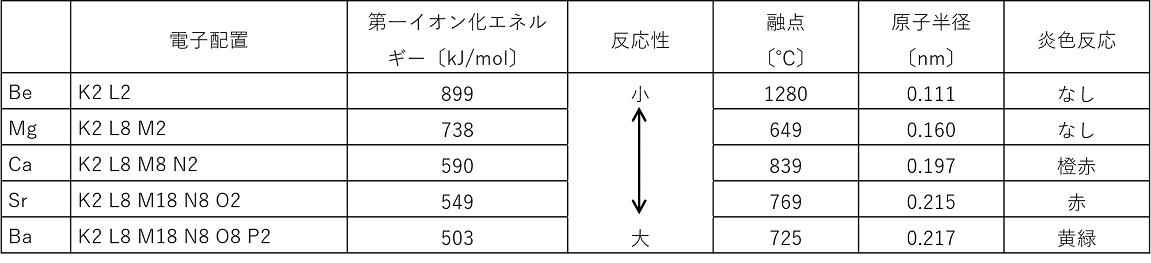
2族元素のBe,Mg,Ca,Sr,Ba,Raを〔 アルカリ土類金属 〕という。2族元素は価電子数が〔 2 〕(最外殻電子数が2個)なので,2価の〔 陽 〕イオンになりやすい。反応性は大きいが〔 アルカリ金属 〕に比べると小さい。反応性はBe,Mgと他のアルカリ土類金属との間で差が見られるが,アルカリ金属と同様に原子番号が増加するほど反応性に富む。
Be,Mgアルカリ土類金属は〔 アルカリ金属 〕と同様の反応をするが,Be,Mgはこれとは異なった反応をする。例えば,アルカリ土類金属は常温の水と反応し,〔 水素 〕を発生する①が,Be,Mgは常温の水とは反応しない。ただし,Mgは〔 熱水 〕とは反応する。2族元素のイオンは炭酸イオンCO32-と反応し,炭酸塩の白色沈殿を生じる。アルカリ土類金属のイオンは硫酸イオンSO42-と反応し,硫酸塩の白色沈殿を生じる②。また,マグネシウムは燃やすと強い光を出して燃え,Ca,Sr,Baは炎色反応を示す。
|
|
|
① 例Caと水〔 Ca + 2H2O → Ca(OH)2 + H2 〕(無機化学の反応式 パターン1 金属と水 ⇒ その金属の水酸化物+α)
② CO32-は,2族のイオンと反応して白色沈殿
例 Mg2+とCO32- 〔 Mg2+ + CO32- → MgCO3 〕
Ca2+とCO32- 〔 Ca2+ + CO32- → CaCO3 〕
SO42-は,アルカリ土類金属のイオンと反応して白色沈殿(Mg2+とは反応しない)
例 Ca2+とSO42- 〔 Ca2+ + SO42- → CaSO4 〕
|
| |
【酸化カルシウム】
|
酸化カルシウムCaOは〔 生石灰 〕ともいわれ,白色の塊状で融点が高い。〔 塩基性 〕酸化物①であり,水と激しく反応して②,多量の熱を発生する。そのため,〔 乾燥剤 〕として用いられる。また,酸化カルシウムと水酸化ナトリウムの混合物を〔 ソーダ石灰 〕といい,これも乾燥剤として用いられる。コークスとともに強熱すると,炭化カルシウムCaC2(カーバイド)と一酸化炭素が生成する③。
|
|
|
① 金属の酸化物は水と反応して塩基になるので塩基性酸化物という(反応は②参照)。ただし,Al,Zn,Sn,Pbの酸化物は酸とも塩基とも反応するので,両性酸化物という。
② 〔 CaO + H2O → Ca(OH)2 〕 (無機化学の反応式 パターン1 金属の化合物と水 ⇒ その金属の水酸化物+α)
③ 〔 CaO + 3C → CaC2 + CO 〕(特殊な反応式なので覚える)
|
| 【水酸化カルシウム】 |
| 水酸化カルシウムCa(OH)2は白色固体で〔 消石灰 〕と呼ばれる。水に少し溶け,水溶液は〔 石灰水 〕とよばれ強塩基性を示す。石灰水は〔 CO2 〕を吹き込むと,水に不溶の炭酸カルシウムCaCO3の沈殿が生じる④。さらに,CO2を吹き込むと,水に可溶の炭酸水素カルシウムCa(HCO3)2に変化するので,白濁は消え,無色透明の溶液になる⑤。さらに加熱すると再び白濁する⑥。天然でも,岩山の割れ目に,二酸化炭素が溶け込み,石灰石がこの反応によって,溶けて洞穴ができる。これが〔 鍾乳洞 〕である。 |
|
|
④ 〔 Ca(OH)2 + CO2 → CaCO3 + H2O 〕 (無機化学の反応式 パターン2 金属の化合物とCO2 ⇒ その金属の炭酸塩+α
⑤ 〔 CaCO3 + CO2 + H2O → Ca(HCO3)2 〕(無機化学の反応式 パターン8 炭酸水素塩の加熱 ⇒ 炭酸塩+CO2+H2Oの逆)
⑥ 〔 Ca(HCO3)2 → CaCO3 + CO2 + H2O 〕(無機化学の反応式 パターン8 炭酸水素塩の加熱 ⇒ 炭酸塩+CO2+H2O) |
|
【アルカリ土類金属の塩類】
|
|
炭酸カルシウムCaCO3は石灰石,大理石などの主成分として,また,貝殻,サンゴ,卵殻などの成分として自然界に広く分布する。水には不溶だか,CO2を含む水には溶ける。炭酸より強い酸と反応させると,CO2を発生する⑦。また,加熱により分解して二酸化炭素を発生する。
硫酸カルシウムCaSO4のニ水和物CaSO4・2H2Oをセッコウという。セッコウを加熱すると,結晶水が3/2とれてCaSO4・1/2H2Oとなり,これを焼セッコウという。焼セッコウに水を加えると,セッコウに戻る。また,硫酸バリウムBaSO4は水に溶けにくく,酸にも安定である⑧。このため,X線の〔 造影剤 〕に用いられる。
|
|
|
⑦ 例 塩酸と炭酸カルシウム
〔 CaCO3 + 2HCl → CaCl2 + CO2 + H2O 〕(無機化学の反応式 パターン9 弱酸の塩と強酸 ⇒ 弱酸と強酸の塩)
CO2+H2Oは炭酸H2CO3に相当する。
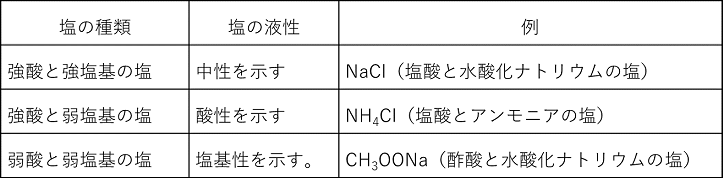
⑧ 塩は酸と塩基の中和によってできる物質である。塩の液性(水溶液にしたときの酸性,塩基性,中性)は,酸と塩基の強弱で次のように決まる。硫酸水素ナトリウムNaHSO4は強酸と強塩基の塩であるが例外的に酸性を示す。硫酸バリウムは硫酸(強酸)と水酸化バリウム(強塩基)の塩なので中性を示す。中性の塩は酸とは反応しないので酸には安定である。
|
 |
 |